新闻动态

新捷报,捷闻报 了解最新捷闻咨询
捷闻说 | 从巴西新规看全球医疗器械 UDI 系统实施现状

2025-09-05
医疗器械唯一标识UDI
医疗器械唯一标识UDI作为全球医疗监管数字化转型的核心工具,是由设备标识符UDI-DI和生产标识符UDI-PI组成的标准化编码体系。
其中,UDI-DI作为静态标识用于永久识别器械基本信息,UDI-PI则包含序列号、批号等动态生产数据,通过 GS1、HIBCC 等国际发码机构实现全球统一编码。
这一电子身份证系统打破了传统追溯体系的碎片化困境,使医疗器械从生产、流通到使用的全生命周期可追溯,为不良事件监测、产品召回和供应链管理提供了技术支撑。
巴西 UDI 系统的分阶段实施战略
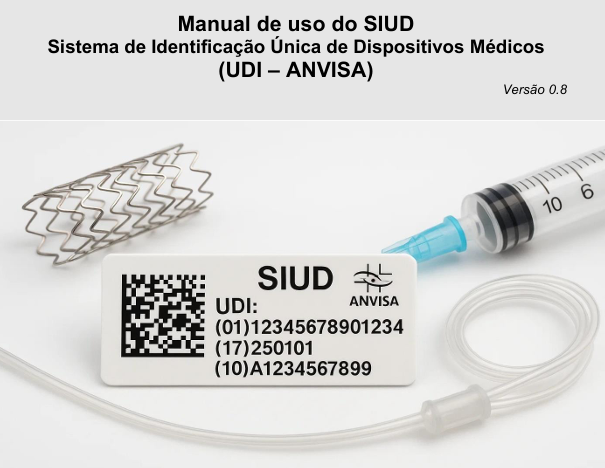
作为拉美地区医疗器械监管升级的重要举措,巴西国家卫生监督局ANVISA于2025 年7月10日正式启动IV类高风险医疗器械的UDI强制实施计划,标志着其医疗器械追溯体系进入数字化时代。
巴西采用风险分级的分阶段推进策略:
- 2025 年 7 月率先覆盖心脏起搏器、人工关节等 IV 类器械;
- 2026 年 1 月扩展至 III 类器械;
- 2027 年 1 月纳入 II 类产品;
将于 2028 年 1 月实现I类低风险器械的全面覆盖。
在技术规范上,巴西允许企业灵活选择一维条形码、二维码或 RFID 等载体形式,但要求符号尺寸符合ISO/IEC国际标准,人工可读文本高度不低于1.5mm。
ANVISA同步上线的国家UDI数据库SIUD要求制造商在产品上市后48小时内上传包括 GMDN代码、灭菌方式等核心数据,违规者将面临最高50万雷亚尔(约80万元人民币)的罚款。
这边捷闻也汇总了中欧美UDI实施现状供大家参考:
中国UDI监管实现状
- 2019 年国家药监局发布《医疗器械唯一标识系统规则》,标志着制度建设正式启动;
- 2021 年 1 月 1 日起,9 大类 69 种第三类高风险医疗器械率先纳入强制实施范围;
- 2022 年 6 月实现所有第三类医疗器械(含体外诊断试剂)全覆盖;
- 2024 年 6 月 1 日,15 大类 103 种第二类医疗器械作为第三批品种进入强制实施阶段。
根据监管规划,我国将于 2026 年启动剩余第二类医疗器械的 UDI 全面覆盖,最终实现所有类别医疗器械的全品类监管目标。随着 ISO 13485:2025 新版标准实施,UDI 在供应链风险管控中的作用将进一步强化,推动企业建立更完善的质量管理体系。
美国UDI监管实现状
- 美国 UDI 监管体系以 2013 年 9 月发布的《唯一器械标识系统最终规则》为法律基础,该规则根据设备风险等级设定差异化合规时间表:
- 高风险三类器械率先于 2015 年 9月完成 UDI 赋码;
- 中等风险二类器械在 2016 年 9 月达标;
- 低风险一类器械及未分类器械则在 2018 年 9 月实现全面覆盖。
2025 年 6 月,FDA 发布《组合产品的唯一器械标识(UDI)要求》草案,标志着监管范围向复杂产品延伸。该草案首次明确含器械组件的组合产品需单独赋码。
欧盟UDI监管实现状
欧盟MDR 和 IVDR 均专章规定了 UDI 相关要求:
- 高风险的 Ⅲ 类器械和可植入器械自2021年5月26日起率先适用 UDI 要求;
- Ⅱa类、Ⅱb类器械和D类诊断器械于2023年5月26日纳入监管;
- 2025年5 月26日成为关键节点,Ⅰ类器械、B类和C类体外诊断器械开始强制实施;
- 风险最低的A类体外诊断器械延迟至2027 年 5 月 26 日全面覆盖。
2025年11月将强制执行的新版MIR表格新增 UDI 发行实体标识选项,进一步完善了产品溯源链条,反映出欧盟在追求监管统一过程中的持续优化。
全球 UDI 发展的趋势
从巴西的分阶段推进到中欧美成熟市场的精细化管理,全球UDI实施呈现出快速发展的趋势。
随着 IMDRF 推动的 UDI 互认机制逐步落地,跨国医疗器械企业面临的合规挑战将从单一市场适应转向全球协同应对。未来,UDI 不仅是监管合规的硬性要求,更将成为医疗器械数字化转型的基础设施,推动全球医疗健康产业向更安全、更高效的方向发展。
End
获取更多相关信息, 您也可以直接联系我们。
我们将竭诚为您服务!



