新闻动态

新捷报,捷闻报 了解最新捷闻咨询
捷闻说 | 医疗器械的生物相容性:理解关键概念与挑战

2024-09-06
医疗器械的生物相容性评估是确保产品安全、有效和符合法规要求的必要步骤。然而,对于医疗器械领域的专业人士而言,这一过程的复杂性和多样性往往带来不小的挑战。本文将探讨生物相容性测试的基本概念,以及在器械设计和开发过程中如何有效应对这些挑战。
医疗器械生物相容性的概念?
医疗器械的生物相容性是指医疗器械与人体组织、体液接触时,材料不会引起不可接受的局部或全身生物反应的能力。
生物相容性评估确保医疗器械在使用过程中不会对人体造成伤害,如皮肤刺激、过敏反应、细胞毒性、遗传毒性、致癌性等。这一评估对于确保医疗器械的安全性和有效性至关重要。
几乎所有的医疗器械都需要进行生物相容性评估,尤其是那些与人体直接或间接接触的器械。
直接接触包括器械直接与人体组织接触,如植入物、导管、手术工具等;间接接触则涉及器械通过液体或气体与人体间接接触,例如呼吸机、血液透析设备等。生物相容性测试的范围和深度取决于医疗器械的预期用途、接触方式、接触时间和材料特性。
例如,植入式器械需要进行更为全面的生物相容性评估,以确保长期植入不会对人体造成不良影响;而仅与皮肤表面接触的器械可能需要进行皮肤刺激性和致敏性测试。
我的产品需要进行生物相容性测试吗?
简短的回答是,与人体组织接触的医疗器械几乎总是需要进行生物相容性测试。
1. 参考ISO 10993系列标准和相关法规指南,如FDA的指南,以确定具体测试要求。
根据器械与人体的接触方式(如皮肤接触、血液接触、植入等)和接触时间(如暂时、长期)来确定测试的必要性和范围。
2. 评估器械所用材料的生物相容性。如果使用的材料与之前经过充分测试的材料基本相同,可以考虑减少测试需求。然而,任何材料或工艺的重大变化,如灭菌方法、制造过程的改变、患者接触性质的改变、材料化学成分的变化或材料选择的更改,都可能需要进行额外的测试以确认生物相容性。
3. 如果材料供应商已经进行了相关的生物相容性测试,制造商应要求并审查这些数据,以评估是否满足自己的测试需求。
4. 如果存在临床历史,如已上市的类似设备或使用相似材料的设备,这些数据可以作为减少测试需求的依据。
5. 化学分析数据可以用于验证材料的成分和潜在的生物反应性,从而在一定程度上确认材料的生物相容性。
FDA 指南中的流程图,可帮助您决定是否需要进行生物相容性测试:
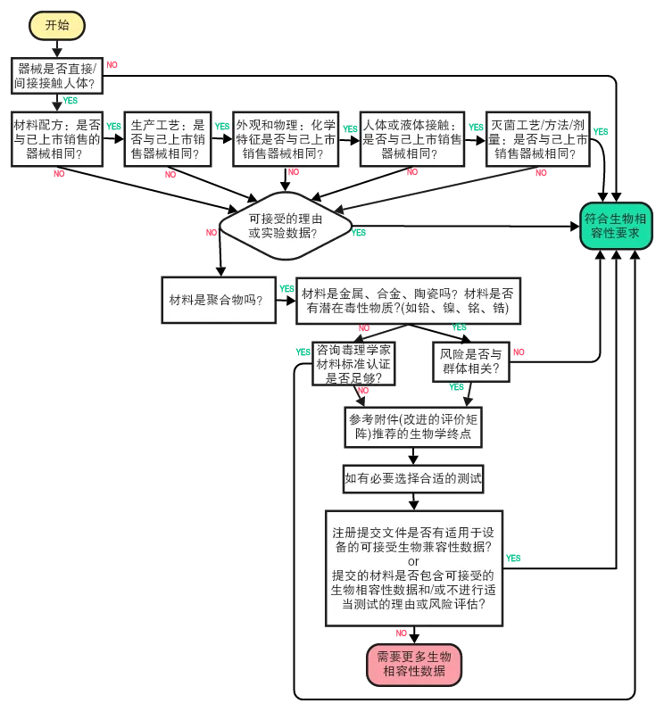
如何为医疗器械制定生物相容性测试计划?
确保医疗器械的生物相容性是一个多步骤的过程,涉及到风险评估、测试和报告。以下是制定生物相容性测试计划的三个主要步骤,以确保您的医疗器械符合安全性和合规性要求:
1. 制定生物评估计划(BEP)
生物评估计划是生物相容性测试流程的起点。在这个阶段,您需要:
- 审查医疗器械的构成材料,包括直接接触人体的材料和间接影响的材料,如涂层、内部组件等。
-基于材料特性和器械的预期用途,识别可能的生物相容性风险。
-基于风险识别,确定需要进行哪些类型的生物相容性测试,包括但不限于细胞毒性、致敏性、遗传毒性、植入反应等。
BEP可以作为初步的风险评估,并在提交前讨论中与FDA分享。这有助于确保您的测试计划符合监管要求,并可能减少后期的测试需求或避免不必要的测试。
2. 设备评估和测试
根据BEP中确定的测试,进行具体的生物相容性评估。测试可能包括:
- 用于评估器械与人体组织接触时的反应。
- 分析器械材料的化学成分,评估潜在的有害物质释放。
- 基于化学测试结果,评估潜在的毒理学风险。
- 利用已有的科学数据和文献,评估材料的生物相容性。
测试应遵循国际标准,如ISO 10993系列,ISO 18562系列,牙科材料专用标准以及FDA的指南等。
3. 制作生物评价报告(BER)
BER是生物相容性测试流程的总结,它应包括:
- 详细描述进行的测试类型和方法。
- 提供所有测试的详细结果,包括任何发现的生物反应。
- 基于测试结果,评估器械的生物相容性,并得出结论。
BER将作为医疗器械注册或上市前审批的一部分提交给FDA。确保BER全面、准确,能够清晰展示您的医疗器械符合生物相容性的要求。
通过遵循这些步骤,您可以系统地评估和管理与生物相容性相关的风险,确保医疗器械的安全性和有效性,同时满足监管机构的要求。
结论
医疗器械的生物相容性评估是确保产品安全性和符合法规要求的必要步骤。对于医疗器械专业人士而言,理解生物相容性的概念和测试流程是至关重要的,它能够帮助他们在设计和开发过程中做出明智的决策,确保产品满足高标准的安全要求。
End
获取更多相关信息, 您也可以直接联系我们。
我们将竭诚为您服务!



